Makati Libros Magicos
La tabla periódica y los tipos de uniones o enlaces químicos
lunes, 10 de enero de 2022
domingo, 9 de enero de 2022
“Hansel y Gretel”
Jacob Grimm y Wilhelm Grimm
Hansel y Gretel son dos hermanos hijos de un leñador pobre, que al no tener que comer debido a la hambruna por la que pasaba la región, son abandonados en un bosque encantado. Los niños deberán buscar la manera de regresar a su hogar, pero para ello se enfrentarán a diversos problemas en los que tendrán que demostrar su ingenio, inteligencia, astucia y trabajo en equipo para poder solucionarlos.
miércoles, 9 de noviembre de 2016
Historia de la tabla periodica
Los seres humanos siempre hemos estado tentados a encontrar
una explicación a la complejidad de la materia que nos rodea. Al principio se
pensaba que los elementos de toda materia se resumían al agua, tierra, fuego y
aire. Sin embargo al cabo del tiempo y gracias a la mejora de las técnicas de
experimentación física y química, nos dimos cuenta de que la materia es en
realidad más compleja de lo que parece. Los químicos del siglo XIX encontraron
entonces la necesidad de ordenar los nuevos elementos descubiertos. La primera
manera, la más natural, fue la de clasificarlos por masas atómicas, pero esta
clasificación no reflejaba las diferencias y similitudes entre los elementos.
Muchas más clasificaciones fueron adoptadas antes de llegar a la tabla
periódica que es utilizada en nuestros días.
En 1869, Mendeleïev, químico ruso, presenta una primera
versión de su tabla periódica en 1869. Esta tabla fue la primera presentación
coherente de las semejanzas de los elementos. El se dio cuenta de que
clasificando los elementos según sus masas atómicas se veía aparecer una
periodicidad en lo que concierne a ciertas propiedades de los elementos.
Esta tabla fue diseñada de manera que hiciera aparecer la
periodicidad de los elementos. De esta manera los elementos son clasificados
verticalmente. Las agrupaciones horizontales se suceden representando los
elementos de la misma “familia”.
Para poder aplicar la ley que él creía cierta,
tuvo que dejar ciertos huecos vacíos. Él estaba convencido de que un día esos
lugares vacíos que correspondían a las masas atómicas 45, 68, 70 y 180, no lo
estarían más, y los descubrimientos futuros confirmaron esta convinción. El
consiguió además prever las propiedades químicas de tres de los elementos que
faltaban a partir de las propiedades de los cuatro elementos vecinos. Entre
1875 y 1886, estos tres elementos: galio, escandio y germanio, fueron
descubiertos y ellos poseían las propiedades predecidas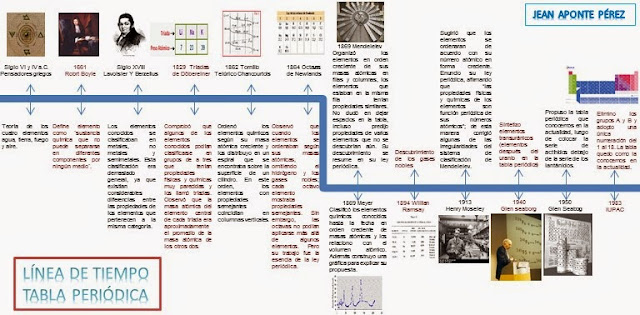
OPINION:
Opinamos que es muy importante conocer como a ido evolucionando la tabla periodica y a quienes se debe la existencia de esta.
AUTORES: TIARE CATZIN POOL
SOFIA PAT CUA.
https://www.google.com.mx/search?q=historia+de+la+tabla+periodica&biw=1366&bih=662&source=lnms&tbm=isch&sa=X&sqi=2&ved=0ahUKEwj7xvHv8pzQAhXINSYKHXJPAiIQ_AUIBigB#tbm=isch&q=tabla+periodica&imgrc=5nsGE7dsT
https://es.wikipedia.org/wiki/Tabla_peri%C3%B3dica_de_los_elementos
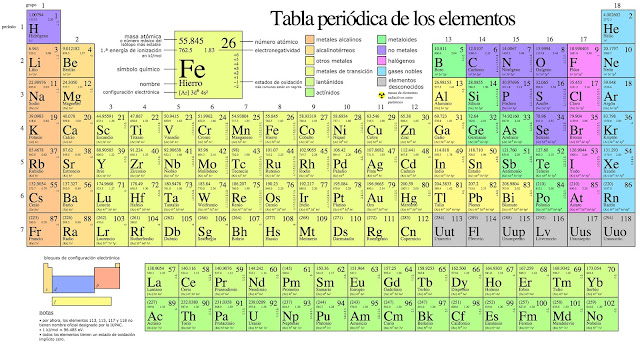
Clasificacion de los elementos

Ø
GRUPOS: Son las columnas o filas verticales de
la tabla periódica. La tabla periódica consta de 18 grupos. Éstos se designan
con el número progresivo, pero está muy difundido el designarlos como grupos A
y grupos B númerados con con números romanos. Las dos formas de designarlos se
señalan en la tabla periódica mostrada al inicio del tema.
Ø
FAMILIAS: Están formadas por los elementos
representativos (grupos "A") y son:
GRUPO
|
FAMILIA
|
I A
|
Metales alcalinos
|
II A
|
Metales alcalinotérreos
|
III A
|
Familia del boro
|
IV A
|
Familia del carbono
|
V A
|
Familia del nitrógeno
|
VI A
|
Calcógenos
|
VII A
|
Halógenos
|
VIII A
|
Gases nobles
|
Ø BLOQUES:Es un arreglo de
los elementos de acuerdo con el último subnivel que se forma.
BLOQUE
"s"
|
GRUPOS
IA Y IIA
|
|
BLOQUE
"p"
|
GRUPOS
III A al VIII A
|
|
BLOQUE
"d"
|
ELEMENTOS
DE TRANSICIÓN
|
|
BLOQUE
"f"
|
ELEMENTOS
DE TRANSICIÓN INTERNA
|
|
Ø
METALES,NO METALES Y SEMIMETALES:
METALES: Ocupan las zonas izquierda y central de la Tabla
Periódica; por tanto, constituyen un grupo mayoritario de los elementos.
Presentan propiedades físicas y químicas variadas. Se caracterizan por:
Su brillo metálico.
El color del metal depende de la luz que refleja, por
ejemplo, el cobre (Cu) es rojo, el oro (Au) es amarillo.
Son sólidos a temperatura
ambiente, excepto el mercurio que es líquido.
Son dúctiles (pueden dar forma de hilos).
Son maleables (pueden convertirse en láminas).
Son tenaces, pues la mayoría de ellos resisten a la ruptura.
Son buenos conductores del calor y la electricidad.
Tienen elevados puntos de fusión.
Algunos metales típicos son hierro, sodio, plata, oro,
magnesio, zinc, estaño, plomo, entre otros.

NO METALES: Se ubican en la región superior derecha de la
Tabla Periódica.
A temperatura ambiente suelen ser sólidos,
como carbono (C), fósforo (P), azufre (S), selenio (Se), yodo (I); líquidos,
como el bromo (Br); gases como hidrógeno (H), nitrógeno (N), oxígeno (O), flúor
(F), cloro (Cl).
Son malos conductores de la electricidad.
Tienen puntos de fusión bajos y bajas densidades.
No son brillantes.
Reaccionan entre sí y con los metales.
Algunos no metales tienen particular importancia por sus
aplicaciones. El cloro es un químico que se usa en la purificación del agua y
en la elaboración de solventes para lavado en seco.
El nitrógeno se emplea en la fabricación de fertilizantes,
preparación de explosivos. Se usa también para inflar los paquetes y envasar
los productos al vacío.
El oxigeno se usa para el afinado del acero, también como el
combustible de cohetes y misiles. En el campo de la medicina como componente
del aire artificial para aquellas personas con insuficiencias respiratorias. El
ozono, forma alotrópica del oxígeno, se usa como bactericida, decolorante de
aceites, ceras y harinas.

SEMIMETALES: Se
sitúan entre los metales y los no metales. Se comportan unas veces como metales
y otras como no metales. Son elementos semimetálicos el boro (B), el silicio (Si),
el germanio (Ge), el arsénico (As), el telurio (Te) y el astato (At). Son
sólidos a temperatura ambiente, son duros y quebradizos. Se usan como
semiconductores porque funcionan como conductores o aislantes.
Ø
IMPORTANCIA Y CARACTERISTICAS DE LOS METALES: En
la vida cotidiana y en forma histórica se utiliza a los metales como
Utensilios, lo que permite un mejor manejo de los alimentos a la hora de
preparar las distintas recetas, como también en Cortar y Trozar los mismos,
además de emplearse los metales, por su gran Conductividad Térmica, como
distintos elementos de cocina que permiten calentar, hornear y preparar
distintos alimentos.
Es un material que cuenta con la capacidad de ser muy
Maleable y Dúctil, teniendo por un lado la facilidad para poder adoptar
cualquier forma (desde lingotes hasta hilos o laminillas) como también la
posibilidad de brindar una altísima resistencia, sumado a que su Estructura
Cristalográfica le permite recuperar su posición original sin ofrecer
demasiadas modificaciones en el punto que ha sido sometida a distintos Procesos
Fisicoquímicos.
Características:
- Estado Físico: todos son sólidos a excepción del Mercurio
que es líquido a temperatura ambiente
- Color: similar a la plata, a excepción del Cu y el Au.
Presentan brillo metálico
- Presentan maleabilidad
- Ductilidad
- Dureza
- Altos puntos de fusión
- Conductores del calor y la electricidad
- Altas densidades
Ø
IMPORTANCIA Y CARACTERÍSTICAS DE LOS NO METALES:
Los no metales, como el silicio, son muy usados en la elaboración de
transistores y circuitos presentes en muchos aparatos electrónicos. El
nitrógeno, al reaccionar con el hidrógeno, forma amoníaco (sustancia muy
utilizada para la producción de fertilizantes y tintes). El azufre se usa para
la producción de ácido sulfúrico, que sirve como materia prima en muchos
procesos químicos industriales. Los plásticos usados para la fabricación de
diversos productos se obtienen a partir de diferentes no metales.
Características:
- Estado Físico: todos son sólidos a excepción del Mercurio
que es líquido a temperatura ambiente
- Color: similar a la plata, a excepción del Cu y el Au.
Presentan brillo metálico
- Presentan maleabilidad
- Ductilidad
- Dureza
- Altos puntos de fusión
- Conductores del calor y la electricidad
- Altas densidades.
OPINIÓN :
Es muy importante saber como utilizar la tabla periódica así de como esta integrada
es bueno saber su importancia y como podemos distinguirlas.
AUTORES: TIARE CATZIN POOL
SOFIA PAT CUA
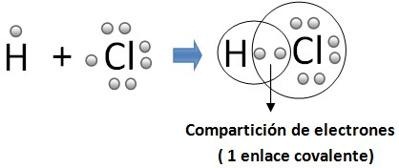
Enlace covalente
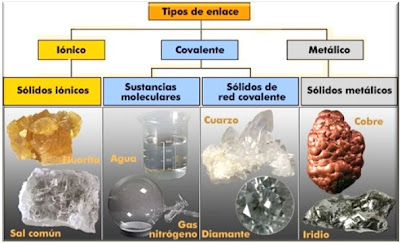
Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...).Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble. Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalentes. Características:
Ejemplos  El gas cloro está formado por moléculas, Cl2, en las que dos átomos de cloro se hallan unidos por un enlace covalente Reflexión TIARE : estos son muy importantes en la vida para nuestro uso como es el agua que esta formado con un enlace covalente. Mi opinión TIARE: Yo opino que es muy importante conocerlas por que es parte de la vida que tenemos y gracias a esta vivimos y seguimos vivos en el mundo,aunque hay cosas que no usamos correctamente y quepueden dañar al ambiente o el mundo en el que habitamos. AUTOR: TIARE CATZIN POOL SOFIA PAT CUA. . http://10ejemplos.com/10-ejemplos-de-enlaces-covalentes |
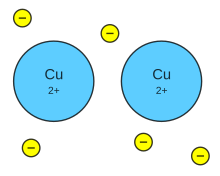
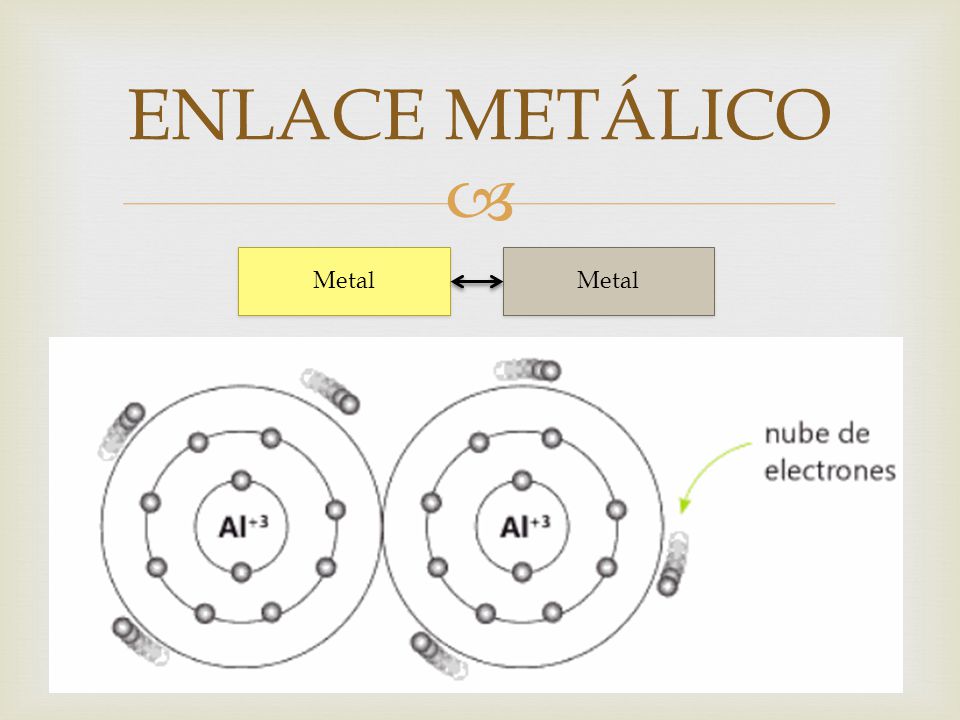
Enlaces Metalicos
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones des localizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
A continuación se presenta un listado con enlaces metálicos a modo de ejemplo:
- Enlace entre átomos de mercurio (2Hg)
- Enlace entre átomos de cadmio (2Cd)
- Enlace entre átomos de oro (2Au)
- Enlace entre átomos de aluminio (2Al)
- Enlace entre átomos de galio (2Ga)
- Enlace entre átomos de titanio (2Ti)
- Enlace entre átomos de hierro (2Fe)
- Enlace entre átomos de plata (2Ag)
- Enlace entre átomos de zinc (2Zn)
- Enlace entre átomos de cobre (2Cu)
- Enlace entre átomos de paladio (2Pd)
- Enlace entre átomos de platino(2Pt)
- Enlace entre átomos de circonio (2Zr)
- Enlace entre átomos de cobalto (2Co)
- Enlace entre átomos de iridio (2Ir)
Mi reflexion :
Este tipo de enlace es muy impórtante por que ayuda en la vida de los seres humanos.
son muy utilizadas en la actualidad por ejemplo en la medicina para algunos tipos de ayuda, por ejemplo ,para ayudar a los dientes en su empaste ,tambien este tipo de enlace se usa en la mecanica o industria automotriz para proteger los metales de la oxidacion ,tambie es usada para fabricar productos como joyas,los utencilios de cocina y objetos como los auriculares que se fabrican de estos. Tambien estos pueden dañar al ambiente con su uso si no se usa de una manera adecuada.

Mi opinion:
Yo opino que es importante conocer mas sobre este tipo de enlaces, ya que nos serviran mas adelante en nuestros estudios; tambien porque se usa para formar nuevos productos que son muy utiles en la vida cotidiana, al ser maleables y ductiles permiten dar origen a nuevas cosa a fin de darnos beneficio y haciendonos mas facil y comoda nuestra vida.
AUTOR:TIARE CATZIN POOL
Suscribirse a:
Entradas (Atom)